10 settembre 2025
Tempo di lettura [minuti]: 22
Tendenze di Mercato e del Settore
Scenari di mercato per i test molecolari distribuiti
Il mercato della diagnostica molecolare si sta spostando dai grandi laboratori a soluzioni distribuite e point-of-care. Dal 2024 al 2030 si prevede una crescita significativa trainata da PCR portatili, test multiplex e integrazione cloud/AI. Ulisse Biomed, con la piattaforma Hyris System™ (bCUBE™, bAPP™, reagenti ambient-stabili), si posiziona come attore end-to-end capace di scalare questa rivoluzione.
Abstract
Panoramica 2024–2030: La diagnostica molecolare globale (circa 25,7 miliardi di dollari nel 2024) sta evolvendo verso modelli decentralizzati, con i test point-of-care molecolari in rapida espansione. Segmenti chiave come la PCR portatile (68% del mercato molecolare odierno) e i pannelli multiplex guidano l’innovazione, mentre l’AI integrata apre nuovi scenari di diagnostica predittiva.
Geografie emergenti: Asia-Pacifico e America Latina registrano i tassi di adozione più alti, spinte da investimenti pubblici e necessità di colmare gap diagnostici[1]. La Cina, ad esempio, vede CAGR ~13,8% nei test POC molecolari.
Driver tecnologici: Soluzioni cloud e algoritmi di AI potenziano l’analisi dei dati in tempo reale, migliorando l’accuratezza e riducendo i tempi di risposta. Reagenti ambient-stabili eliminano la cold chain, semplificando la logistica anche in contesti remoti. L’interoperabilità tra device e sistemi informatici sanitari abilita flussi data-driven e modelli “Diagnostics-as-a-Service” (DaaS).
Leve regolatorie ed economiche: Il nuovo regolamento europeo IVDR alza gli standard di qualità e validazione per i test in vitro, mentre negli USA l’FDA introduce percorsi semplificati (esenzioni 510(k) per device a basso rischio e certificazioni CLIA waiver) per favorire i test decentrati. I sistemi sanitari spingono verso rimborsi value-based, premiando soluzioni diagnostiche che dimostrano impatto clinico e risparmi sui costi.
Decentralizzazione e sostenibilità: Portare i test “dal laboratorio al paziente” aumenta la resilienza della supply-chain (meno dipendenza da centri unici), riduce il TAT (turnaround time) da giorni a minuti, e genera ROI tramite diagnosi precoci che alleggeriscono i costi di cura. Nei prossimi anni, la diagnostica molecolare distribuita si estenderà a segmenti ad alto margine – dal controllo qualità nutraceutico ai servizi OEM personalizzati – abilitando nuovi flussi di ricavi ricorrenti (device + consumabili + software).
Ulisse Biomed: In questo contesto, Ulisse Biomed emerge come provider integrato con Hyris System™: dispositivi PCR portatili, cloud analytics (bAPP) e reagenti proprietari stabili a temperatura ambiente. Questa piattaforma modulare supporta clinici, partner OEM e progetti nutraceutici nel realizzare test avanzati ovunque con accuratezza di livello laboratoriale. L’articolo esamina trend di mercato, case study e scenari futuri, delineando come soluzioni end-to-end come Hyris System™ possano scalare nella nuova era della diagnostica distribuita.
Snapshot
-
Diagnostica molecolare distribuita
Erogazione di test molecolari fuori dai laboratori centralizzati, ad esempio in cliniche periferiche, piccoli laboratori o sul territorio. Mira a portare l’analisi vicino al paziente, riducendo tempi di risposta e necessità di trasporto campioni. È sinonimo di diagnostica decentralizzata applicata a tecnologie molecolari (es. PCR).
-
Point-of-Care (POC)Modalità di testing eseguito direttamente nel luogo di cura o in prossimità del paziente. Include dispositivi rapidi utilizzabili in ambulatorio, pronto soccorso o sul campo, fornendo risultati immediati e affidabili senza ricorrere al laboratorio ospedaliero. È il fulcro della diagnostica distribuita in ambito clinico.
-
PCR (Polymerase Chain Reaction)Tecnica molecolare per amplificare DNA/RNA, considerata il gold standard per numerose diagnosi (es. infezioni). L’evoluzione portatile della PCR consente di effettuare test genetici avanzati on-site con elevata sensibilità, abilitando il POC molecolare.
-
Test multiplexAnalisi che rilevano simultaneamente più target (patogeni, geni) in un solo test. Ad esempio pannelli sindromici che con un unico campione forniscono un quadro diagnostico completo. Aumentano l’efficienza e il valore informativo di ogni test.
-
Reagenti ambient-stabiliKit e reagenti formulati per rimanere stabili a temperatura ambiente (20-30 °C) senza refrigerazione. Facilitano la distribuzione in paesi caldi o zone remote, riducendo costi e complessità della cold chain.
-
IVDRIn Vitro Diagnostic Regulation, regolamento UE 2017/746 che sostituisce la direttiva IVDD. Impone requisiti più stringenti su certificazione, evidenze cliniche, tracciabilità e sorveglianza post-market per i dispositivi diagnostici, impattando sia produttori che laboratori.
-
FDA 510(k) exemptNegli USA, esenzione dalla procedura di pre-market notification 510(k) per dispositivi diagnostici di classe I (e alcuni di classe II) a basso rischio. In pratica, permette l’immissione in commercio senza presentare dati comparativi, snellendo l’iter regolatorio. Spesso associato a test semplici o già ben consolidati.
-
CLIA WaiverCertificazione USA (Clinical Laboratory Improvement Amendments) che classifica un test diagnostico come “di bassa complessità”, permettendone l’esecuzione anche al di fuori di laboratori certificati, ad es. in farmacia o studio medico. Fondamentale per diffondere i POC test negli ambiti non specialistici.
-
Diagnostics-as-a-Service (DaaS)Modello di business in cui la diagnostica viene offerta come servizio integrato anziché tramite vendita di apparecchiature. Tipicamente combina device in comodato, reagenti dedicati, piattaforme cloud e supporto analitico, con fatturazione tramite abbonamenti o pay-per-test (sul modello SaaS).
- Introduzione
- 1. Mercato globale e segmenti dominanti (2024–2030)
- 2. Adozione nelle geografie emergenti
- 3. Driver tecnologici: cloud, reagenti innovativi, interoperabilità, AI
- 4. Leve regolatorie e rimborso: ostacoli o acceleratori?
- 5. Decentralizzazione come leva di sostenibilità e scalabilità
- 6. Espansione in segmenti ad alto margine: nutraceutica, OEM, nuovi use-case
- 7. Scenari futuri: consolidamento competitivo, M&A e piattaforme integrate
- 8. Posizionamento Ulisse Biomed: la visione end-to-end
- Conclusioni
Introduzione
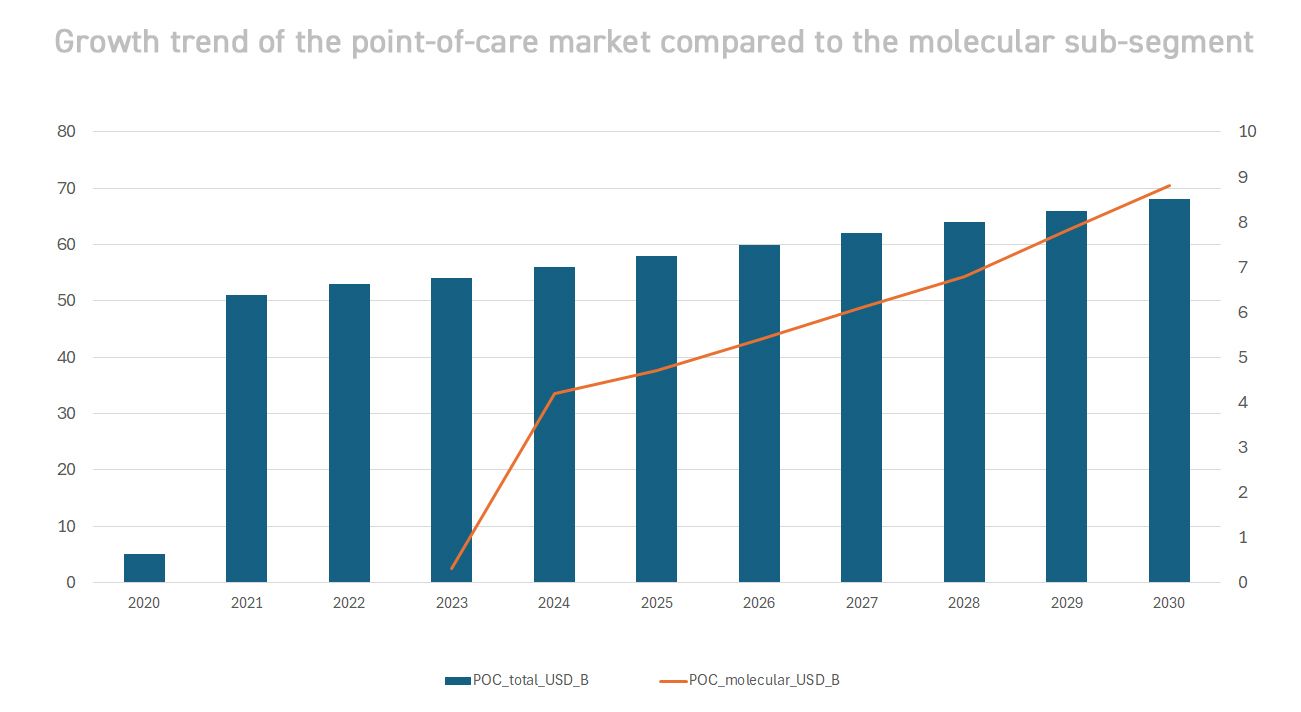
La diagnostica medica vive una trasformazione radicale, passando da un modello centrato su grandi laboratori ospedalieri a un paradigma distribuito sul territorio. Complici i progressi tecnologici (strumentazione miniaturizzata, sensori ottici avanzati, connettività cloud) e le lezioni della pandemia COVID-19, i test molecolari avanzati oggi raggiungono il paziente ovunque si trovi. L’obiettivo è duplice: accelerare i tempi di risposta clinica e ampliare l’accesso alle diagnosi in contesti prima esclusi (aree rurali, Paesi emergenti, setting extraospedalieri). Il risultato è un settore in forte fermento, con tassi di crescita a doppia cifra e nuovi modelli operativi. Secondo le stime, il mercato globale della diagnostica decentralizzata (incluso tutto il point-of-care) vale già decine di miliardi di dollari e continua ad espandersi[2]. In particolare, la diagnostica molecolare POC – test genetici rapidi eseguiti direttamente sul luogo di cura – è la frontiera più dinamica. Pur rappresentando ancora una quota minoritaria del mercato diagnostico totale, sta crescendo molto più velocemente: si prevede che il valore globale dei test molecolari POC passi da ~3,7 miliardi di dollari nel 2023 a ~8,8 miliardi nel 2030, con CAGR ~11-12%. Questa crescita supera nettamente quella media del mercato POC complessivo (~5-6% annuo[2]), segno che le tecnologie avanzate come la PCR portatile stanno trainando l’espansione. Il trend riflette un cambio di approccio: sempre più diagnosi vengono eseguite vicino al paziente, riducendo attese e migliorando gli esiti clinici – un’esigenza resa evidente durante la pandemia, quando i test rapidi sul campo divennero strumenti essenziali di sanità pubblica.
“Il trend di crescita della diagnostica decentralizzata non è solo quantitativo, ma qualitativo. Cambia il modo in cui generiamo valore: non più solo dispositivi, ma piattaforme integrate, dati e servizio continuo.”
- Nicola Basile, CEO di Ulisse Biomed
1. Mercato globale e segmenti dominanti (2024–2030)
Il mercato globale della diagnostica molecolare raggiungerà nel 2030 circa 33 miliardi di dollari. All’interno di questo, la quota svolta in laboratorio centralizzato rimane prevalente (≈79% nel 2024), ma la porzione decentrata guadagna terreno anno dopo anno. I segmenti dominanti che caratterizzano questa evoluzione includono:
- PCR e test ispirati alla PCR: La PCR tradizionale e in tempo reale costituisce ancora la tecnologia di riferimento, rappresentando ~68% delle revenue molecolari nel 2024. La sua affidabilità e sensibilità ne fanno il gold standard. Negli ultimi anni sono emerse varianti portatili e rapide: mini-PCR da campo, sistemi microfluidici e tecnologie isoterme (LAMP, CRISPR-based) che estendono l’uso della biologia molecolare fuori dal lab.
- Point-of-Care Testing (POCT): I test rapidi sul campo, incluse sia metodiche molecolari che immunologiche, stanno rimodellando il settore. Il mercato POC globale (tutte le tecnologie) è previsto crescere da 47,8 miliardi $ (2024) a ~68,5 miliardi $ nel 2030[2]. All’interno di esso, come visto, il sotto-segmento molecolare POC cresce più velocemente di ogni altro. Driver di questa espansione sono l’invecchiamento della popolazione globale (che aumenta la domanda diagnostica), la diffusione di malattie infettive emergenti e la spinta verso cure territoriali. In molti paesi, eseguire test complessi in loco ha migliorato l’appropriatezza clinica (diagnosi più precoci, terapie tempestive) e l’efficienza del sistema sanitario. Per esempio, l’introduzione di test molecolari POC per HIV e tubercolosi in contesti rurali ha portato a significativi risparmi sui costi di trattamento e a un aumento delle adesioni alle cure.
- Test multiplex e sindromici: La capacità di analizzare più target contemporaneamente con un unico campione sta diventando cruciale, soprattutto in infettivologia e genetica. Pannelli sindromici multipathogen (es. pannello respiratorio che identifica con un test influenza, COVID-19, RSV, ecc.) consentono diagnosi differenziali rapide e guidano scelte terapeutiche mirate. Il mercato dei multiplex assay (comprendendo sia test molecolari che immunologici multipli) è stimato in forte crescita, con vantaggi evidenti rispetto ai test singoli in termini di efficienza e value per test. L’accesso a multiplex POC (es. cartridge portatili che testano decine di agenti patogeni) rimane per ora limitato ai contesti avanzati, ma entro il 2030 si prevedono soluzioni più economiche che ne allargheranno la diffusione.
- AI-driven diagnostics: L’intelligenza artificiale sta emergendo come segmento di mercato trasversale, applicato sia all’analisi molecolare che all’imaging. Il mercato globale delle soluzioni di intelligenza artificiale per la diagnostica (clinica e molecolare) crescerà da ~2,6 miliardi $ nel 2024 a ~8,9 miliardi $ nel 2029 (CAGR ~27,6%). In ambito molecolare distribuito, l’AI viene integrata per interpretare automaticamente curve di amplificazione PCR, segnalare anomalia o risultati dubbi, e ottimizzare i protocolli tramite algoritmi di machine learning. Ad esempio, sistemi di interpretazione automatica delle curve di analisi possono validare un test POC in tempo reale, riducendo gli errori umani. Inoltre, l’AI consente di correlare i dati diagnostici con informazioni cliniche: piattaforme cloud avanzate possono incrociare il risultato di un test molecolare con cartelle cliniche e parametri vitali, fornendo al medico indicazioni aggiuntive (es. rischio di complicanze, suggerimenti terapeutici personalizzati). Queste applicazioni, sebbene in fase iniziale, delineano uno scenario in cui ogni test distribuito genera big data da sfruttare per insight di popolazione e modelli predittivi di salute.
In sintesi, il mercato dei test molecolari distribuiti nel 2024–2030 è caratterizzato da un robusto ritmo di crescita e da un arricchimento funzionale: non solo più test e dispositivi in circolazione, ma test migliori (multiplex, più rapidi, più intelligenti) che ne aumentano l’impatto clinico. I segmenti PCR portatile e POC molecolare rimarranno il motore principale, mentre AI e multiplexing fungeranno da moltiplicatori di valore.
2. Adozione nelle geografie emergenti
Mentre Nord America ed Europa occidentale guidano attualmente il mercato in termini assoluti (es. ~41% del mercato molecolare 2024 è nel Nord America), le geografie emergenti mostrano il potenziale di crescita più elevato. In Asia-Pacifico e America Latina, la diagnostica distribuita viene abbracciata come soluzione per espandere l’accesso e colmare la carenza di laboratori centralizzati.
Asia-Pacifico (APAC)
La regione APAC sta vivendo un vero boom della diagnostica POC. La Cina in particolare, seconda economia mondiale, avanza a un CAGR del 13-14% annuo nel segmento POC molecolare: entro il 2030 il mercato cinese dei test POC MDx raggiungerà ~$1 miliardo. Anche altri paesi asiatici vedono tassi a doppia cifra: India, Sud-est asiatico e Corea del Sud investono in soluzioni portatili per portare test avanzati nelle comunità rurali. Ad esempio, il governo indiano ha lanciato programmi per dotare i centri sanitari periferici di strumenti PCR portatili per tubercolosi e COVID-19. L’infrastruttura sanitaria in espansione (nuovi ospedali, cliniche mobili) e la prevalenza elevata di malattie infettive endemiche (dengue, influenza aviaria, ecc.) alimentano la domanda di diagnostica rapida sul territorio. APAC è anche un terreno fertile per partnership pubblico-private: startup locali propongono soluzioni POC a costi ridotti, mentre colossi globali stringono accordi con ministeri della salute asiatici per forniture su larga scala. Il risultato è che l’Asia-Pacifico sarà probabilmente la regione a crescita più rapida per la diagnostica distribuita entro il 2030[3].
America Latina (LATAM)
I paesi latinoamericani stanno recuperando terreno, spinti dall’urgenza di ridurre le disuguaglianze sanitarie. Molti sistemi sanitari LATAM stanno decentralizzando i servizi diagnostici: ad esempio, diversi stati federali in Brasile hanno implementato reti di laboratori periferici dotati di PCR real-time per il monitoraggio di Zika, Dengue e COVID-19. In America Centrale e nei Caraibi, ONG e programmi internazionali (come PAHO/WHO) hanno introdotto dispositivi portatili nei programmi di controllo di HIV e tubercolosi. Secondo un report, il mercato della diagnostica molecolare in LATAM dovrebbe quasi raddoppiare passando da ~$1,1 mld nel 2024 a >2,5 mld nel 2033 (CAGR ~10%). La spinta viene sia da investimenti pubblici (es. la decentralizzazione dei test IVD in alcuni paesi ha incentivato operatori privati a offrire soluzioni POC a basso costo[1]) sia da iniziative private innovative. Per esempio, in Colombia e Messico alcune cliniche private offrono pacchetti di prevenzione che includono test molecolari POC (HPV, STI) eseguiti direttamente in farmacia o presso il medico di base, facilitando screening di massa. Nonostante sfide come budget limitati e infrastrutture a volte carenti, la traiettoria è chiara: LATAM abbraccia la diagnostica distribuita per ampliare la copertura sanitaria.
Africa & Middle East
In Africa l’adozione è più eterogenea ma promettente: paesi come Kenya, Sudafrica e Nigeria stanno investendo in apparecchiature POC grazie a fondi globali (es. PEPFAR, Global Fund)[1]. In Kenya, ad esempio, il governo ha stanziato 346 milioni $ per modernizzare le strutture periferiche con nuovi dispositivi, coinvolgendo aziende globali come GE Healthcare e Philips[1]. La diagnostica POC viene vista come strumento per raggiungere aree remote e migliorare gli esiti per malattie come HIV infantile (EID) e malaria. Studi pilota in Uganda e Rwanda sull’uso di PCR portatili per la tubercolosi hanno mostrato un aumento significativo dei casi diagnosticati precocemente, con riduzione della trasmissione comunitaria. Nel Medio Oriente, paesi del Golfo (Emirati, Arabia Saudita) stanno adottando tecnologie POC avanzate nei loro sistemi sanitari high-tech, mentre regioni a risorse limitate beneficiano di progetti umanitari che portano test rapidi sul campo (es. durante epidemie di Ebola o colera).
Emerging markets in generale presentano un terreno fertile per la diagnostica molecolare distribuita perché uniscono bisogno (malattie infettive diffuse, minor accesso ai test centralizzati) e opportunità (crescita economica, investimenti in sanità). Tuttavia, sfide restano: in alcune aree mancano filiere di manutenzione e supply chain stabili per garantire i consumabili; inoltre servono programmi di formazione per operatori locali sull’uso di nuove tecnologie. Nonostante ciò, gli analisti concordano che APAC, LATAM e Africa contribuiranno in modo sostanziale alla crescita globale del settore POC nei prossimi 5-10 anni[1]. Per aziende come Ulisse Biomed, queste regioni rappresentano spazi bianchi dove posizionarsi precocemente può portare vantaggi competitivi duraturi.
3. Driver tecnologici: cloud, reagenti innovativi, interoperabilità, AI
L’evoluzione del mercato dei test distribuiti è abilitata da una convergenza di innovazioni tecnologiche. Queste non solo migliorano le prestazioni dei singoli test, ma creano un ecosistema in cui hardware, chimica e software operano in sinergia.
Connettività cloud e piattaforme software: La capacità di connettere dispositivi POC ad applicazioni cloud ha trasformato la diagnostica in un flusso continuo di dati. Ogni bCUBE™ o strumento equivalente può inviare in tempo reale risultati al cloud (come la piattaforma bAPP™ di Ulisse Biomed) dove vengono archiviati, elaborati e resi disponibili ai clinici da qualsiasi luogo. Ciò abilita dashboard centralizzate per monitorare decine di punti diagnostici distribuiti (utile per reti di cliniche o programmi pubblici) e consente la tele-diagnosi: specialisti in remoto possono validare un risultato o supportare decisioni terapeutiche. Inoltre, l’aggiornamento software over-the-air permette di migliorare costantemente le performance dei dispositivi sul campo (es. nuovi algoritmi di analisi, integrazione di nuovi pannelli test). Le piattaforme cloud aprono la strada a modelli di servizio ricorrente: ad esempio, accesso in abbonamento a moduli analitici avanzati, reportistica automatica per cliniche, o marketplace online di test sviluppati da terze parti (OEM). Questo approccio “digital-first” crea ecosistemi diagnostici scalabili e integrabili nei sistemi informativi sanitari esistenti (EMR, LIS) tramite API, assicurando interoperabilità end-to-end.
Reagenti ambient-stabili e soluzioni “ready-to-use”: Uno dei fattori spesso sottovalutati ma cruciali per la scalabilità dei test distribuiti è la robustezza dei reagenti. Storicamente, molti test molecolari richiedevano reagenti refrigerati o congelati, ostacolando l’uso in contesti senza cold chain. Oggi aziende innovative producono kit liofilizzati o formulati per essere stabili a temperatura ambiente per mesi.. Ulisse Biomed stessa ha sviluppato reagenti proprietari “ambient-stabili” per il sistema Hyris, facilitando la spedizione globale senza logistica refrigerata. Questi progressi riducono drasticamente i costi e i tempi di distribuzione, aumentano la shelf-life dei test (importante per mercati con volumi inizialmente bassi) e abilitano l’utilizzo on-demand: un operatore può effettuare un test ovunque con pochi step, dato che i reagenti sono pronti all’uso e robusti rispetto a sbalzi termici. Anche i consumabili stanno diventando più user-friendly, con cartridge monouso e sistemi di preparazione del campione semplificati (es. estrazione automatica integrata), così che anche personale non di laboratorio possa eseguire test complessi con facilità.
Interoperabilità e standard aperti: In un ecosistema con molti nuovi dispositivi e piattaforme, l’interoperabilità è fondamentale per evitare silos di dati. Sta emergendo l’adozione di standard sia a livello di formato dati che di comunicazione (API e SDK aperti per consentire a sviluppatori terzi di interfacciarsi con i dispositivi). Ad esempio, la piattaforma bAPP™ offre API per integrare i dati del bCUBE™ nei sistemi ospedalieri o nei database di sorveglianza epidemiologica. Questo consente di sommare i vantaggi del locale (risultato immediato dove serve) con quelli del centrale (analisi aggregata di big data). L’interoperabilità facilita anche modelli di co-sviluppo: partner OEM possono creare sul cloud nuovi algoritmi di interpretazione o pannelli diagnostici custom, estendendo l’ecosistema di una piattaforma come Hyris System™. In prospettiva, la federazione di dati diagnostici provenienti da migliaia di nodi POC permetterà training di algoritmi AI sempre più accurati mantenendo i dati localizzati (federated learning), e creerà basi informative per sanità pubblica (es. monitoraggio in tempo reale di focolai infettivi tramite rete di test distribuiti).
Intelligenza Artificiale integrata: Come accennato, l’AI gioca un ruolo crescente. Già oggi esistono moduli di controllo di qualità intelligente: software in grado di rilevare automaticamente, ad esempio, un’anomalia nella curva di amplificazione PCR (indicando inibizione o errore di pipettaggio) e invalidare il risultato prima che venga refertato, riducendo falsi negativi/positivi. Aziende stanno sviluppando assistenti AI per guidare l’operatore in tempo reale (con suggerimenti passo-passo sul dispositivo). Sul fronte clinico, algoritmi di interpretazione combinano multipli risultati: ad es., in un pannello multiplex respiratorio l’AI può aiutare a distinguere se coinfezioni multiple seguono pattern tipici, o segnalare quando un certo combinato di marker suggerisce un certo percorso terapeutico. Inoltre, nell’ambito delle analisi genetiche, l’AI aiuta a prioritizzare variant calling e interpretazione clinica direttamente al point-of-care (utile nei test di farmacogenomica o oncologia su campo). Entro il 2030 è plausibile che i referti prodotti da piattaforme distribuite includeranno una sezione “AI insights” spiegabile, ovvero indicazioni aggiuntive generate da AI ma accompagnate da spiegazioni comprensibili.
Complessivamente, questi driver tecnologici stanno convergendo verso un nuovo standard di soluzione: non più il singolo dispositivo o reagente, ma l’ecosistema diagnostico integrato. Aziende come Ulisse Biomed che hanno investito in un approccio end-to-end (hardware + software + reagenti + AI) si trovano in una posizione di vantaggio, potendo controllare l’intera esperienza utente e ottimizzare ogni componente per funzionare armoniosamente. Questo si traduce in un valore aggiunto percepibile dagli utenti finali (clinici, laboratori, partner industriali): maggiore facilità d’uso, affidabilità e capacità di evolvere nel tempo seguendo i progressi tecnologici.
4. Leve regolatorie e rimborso: ostacoli o acceleratori?
Il contesto regolatorio e delle politiche di rimborso gioca un ruolo determinante nell’adozione su larga scala delle nuove soluzioni diagnostiche. Nel periodo 2024–2030 si intrecciano sfide e opportunità provenienti da normative più stringenti da un lato, e da incentivi al cambiamento dall’altro.
- IVDR in Europa: L’entrata in piena applicazione dell’IVDR (Regolamento EU 2017/746) sta avendo un impatto significativo sull’industria diagnostica europea. Dalla sua introduzione, qualsiasi nuovo test o dispositivo IVD deve soddisfare requisiti molto più rigorosi in termini di evidenza clinica, controllo qualità e sorveglianza post-market. A lungo termine, l’IVDR innalza l’asticella qualitativa, eliminando dal mercato prodotti obsoleti o poco validati e favorendo aziende con solide basi scientifiche. Per player innovativi come Ulisse Biomed, già allineati a standard elevati, l’IVDR può diventare un vantaggio competitivo: la certificazione di piattaforme POC secondo i nuovi standard garantisce ai clienti (ospedali, laboratori) maggiore fiducia e possibilità di rimborso. Inoltre l’IVDR introduce la classe di dispositivi Companion Diagnostics (CDx) con un percorso dedicato, aprendo opportunità per test molecolari distribuiti associati a terapie specifiche (es. test genetici prima di somministrare un certo farmaco biologico). In sintesi, se nel breve termine l’IVDR è una sfida da gestire (con necessità di consulenza regolatoria esperta, studi clinici robusti, ecc.), nel medio termine costruisce un mercato europeo più solido e affidabile, dal quale i prodotti migliori emergeranno rafforzati.
- FDA e semplificazioni normative: Negli Stati Uniti, la FDA ha storicamente un approccio severo per i dispositivi diagnostici, ma sono in atto alcuni alleggerimenti mirati. Ad esempio, molte classi di device IVD di basso rischio sono state rese 510(k) exempt, ossia esenti dalla procedura standard di premarket notification. Questo riguarda tipicamente test molto semplici o equivalenti ad altri già approvati. Nel campo dei POC molecolari, la strada maestra resta la clearance 510(k) o la de novo (per tecnologie innovative senza predicate device), ma l’FDA ha mostrato flessibilità in contesti di emergenza: durante il COVID-19 ha concesso EUA (Emergency Use Authorization) a numerosi test POC in tempi record, abbassando temporaneamente alcune barriere all’ingresso. Si discute inoltre di un potenziale framework per certi test decentralizzati a basso rischio che potrebbero rientrare in categorie esenti o semplificate. Oltre a ciò, la già citata CLIA waiver gioca un ruolo pratico cruciale: ottenere la CLIA waiver per un dispositivo POC (come previsto dai percorsi FDA per test molecolari CLIA-waived - CLIA Waiver by Application e CLIA Categorizzations [4][5]) significa abilitarne l’uso diffuso in migliaia di poliambulatori e farmacie, senza richiedere personale altamente formato. L’iter per la CLIA waiver richiede dimostrare che il test è “così semplice da minimizzare il rischio di risultato errato” – un obiettivo che guida anche il design dei nuovi dispositivi POC (sempre più automatizzati e fool-proof). In sintesi, negli USA la regolazione sta cercando un bilanciamento tra garantire efficacia/sicurezza e favorire l’innovazione rapida: le esenzioni 510(k) e le CLIA waiver sono leve che, se sfruttate, accelerano l’arrivo sul mercato di tecnologie distribuite.
- Standard qualitativi e certificazioni “green”: Un ultimo elemento emergente: la sostenibilità ambientale nelle forniture sanitarie. Alcuni bandi pubblici (soprattutto in nord Europa) iniziano a includere criteri di impatto ambientale: ad esempio punteggi extra per reagenti che riducono rifiuti biohazard, o per soluzioni che minimizzano emissioni (cold chain, trasporti). In futuro, le piattaforme diagnostiche distribuite potrebbero beneficiare di tale sensibilità se dimostrano un’impronta ecologica inferiore (es. grazie ai reagenti stabili a T ambiente che eliminano tonnellate di ghiaccio secco nelle spedizioni). Anche certificazioni di qualità come ISO15189 per i POCT svolti al di fuori del laboratorio, o programmi di accreditamento specifici per servizi DaaS, potrebbero diventare la norma man mano che la diagnostica distribuita diventa parte integrante del sistema sanitario.
In definitiva, l’ambiente regolatorio 2024-2030 presenta sia barriere da superare che leve da attivare. Le aziende con una solida strategia regulatory & reimbursement – in grado di anticipare i requisiti IVDR, ottenere rapidamente le clearance/waiver FDA e produrre dati di outcome – saranno quelle che trasformeranno i potenziali ostacoli in vantaggi competitivi. Ulisse Biomed, ad esempio, ha integrato sin dall’inizio la compliance regolatoria nel design dell’Hyris System™ e sta investendo in studi clinici e dossier economici per dimostrare il valore della sua soluzione in vari contesti (clinico, nutraceutico, industriale), preparandosi così a dialogare con enti regolatori e payor in modo proattivo.
5. Decentralizzazione come leva di sostenibilità e scalabilità
Implementare una rete di test molecolari distribuiti non è solo una scelta tecnologica, ma anche una strategia di sistema che impatta sostenibilità economica e organizzativa della sanità. Diversi aspetti fanno della decentralizzazione un volano per la scalabilità del servizio diagnostico:
- Ritorno sull’investimento (ROI) e cost saving: Distribuire i test sul territorio può ridurre sensibilmente costi downstream. Diagnosi più rapide significano trattamenti tempestivi, minori complicanze e dunque risparmi per ospedali e assicurazioni. Ad esempio, ogni ora guadagnata nella diagnosi di un infarto miocardico acuto migliora l’esito e riduce i giorni di degenza (costo medio >500 € al giorno). Un test molecolare POC per marker cardiaci, pur costando più del test in central lab, consente di risparmiare migliaia di euro evitando ritardi e terapie intensive non necessarie. Analogamente, nel caso di malattie infettive come influenza o COVID-19, sapere subito il risultato con test PCR in farmacia può evitare prescrizioni inutili di antibiotici o ulteriori accertamenti, con un beneficio economico e clinico. Numerosi studi di health technology assessment hanno quantificato questi vantaggi: Unitaid, ad esempio, ha stimato milioni di dollari di costi di trattamento HIV risparmiati in programmi che hanno introdotto POC EID (Early Infant Diagnosis) in Africa. Dal punto di vista del laboratorio, i test decentrati riducono il carico di lavoro sui centri di riferimento, permettendo di destinare le risorse di laboratorio ai casi più complessi e migliorando l’efficienza operativa generale. Infine, i modelli DaaS spostano la spesa da capex (acquisto strumenti) a opex (costi per test), sincronizzando i costi all’effettivo utilizzo e facilitando la sostenibilità finanziaria nel tempo.
- Resilienza della supply-chain: La pandemia ha insegnato l’importanza di avere catene di approvvigionamento flessibili e robuste. Un modello centralizzato tende ad essere fragile: se il laboratorio hub subisce un sovraccarico o una carenza di reagenti, l’intero sistema ne risente. Al contrario, una rete diffusa di dispositivi POC con reagenti stabili e diversificati è intrinsecamente più resistente a shock. Ad esempio, durante COVID-19 molti paesi hanno integrato piccoli strumenti PCR decentrati per tamponi rapidi: in caso di ritardo nelle forniture verso il central lab, almeno il testing essenziale poteva proseguire localmente. Decentralizzare riduce anche la necessità di trasporto campioni (che durante lockdown e restrizioni ha rappresentato un collo di bottiglia). Meno trasporti e movimentazioni significano meno punti di possibile interruzione. Inoltre, il modello distributed spinge verso la standardizzazione e semplificazione: se hai 100 mini-laboratori territoriali invece di 1 mega-lab, si tenderà a creare kit più facili da distribuire, procedure più snelle e interoperabili. Tutto ciò aumenta la capacità del sistema di adattarsi rapidamente in caso di nuove emergenze sanitarie o variazioni improvvise della domanda (flessibilità scalare). Un esempio concreto: la produzione locale di reagenti. Alcune piattaforme POC permettono a partner locali (es. un’azienda in LATAM) di produrre kit reagenti su licenza, riducendo dipendenza dall’import. Questo non solo accelera i tempi di fornitura ma crea ecosistemi regionali autosufficienti, migliorando la sovranità sanitaria.
- Accessibilità e equità: Dal punto di vista macroscopico, una diagnostica più capillare è sinonimo di maggiore equità nell’accesso alle cure. Ciò ha ricadute positive anche sulla sostenibilità sociale. Raggiungere pazienti che prima erano esclusi (per distanza geografica, costi di viaggio, mancanza di specialisti in loco) significa individuare malattie prima e trattarle prima, riducendo il peso economico delle patologie avanzate sulla società. Pensiamo agli screening neonatali o ai programmi di screening cervicale: portare test HPV DNA direttamente nei distretti sanitari periferici aumenta l’adesione delle donne allo screening e permette di trattare lesioni precancerose prima che evolvano in tumore invasivo – con enorme risparmio di vite e di costi futuri. Allo stesso modo, in contesti rurali la disponibilità di test molecolari rapidi per TB o malaria nelle cliniche locali evita costosi trasferimenti ospedalieri e focolai epidemici. Questi benefici, difficili da monetizzare nell’immediato, si traducono però in sostenibilità di lungo periodo per i sistemi sanitari.
- Scalabilità modulare: Un ulteriore vantaggio della decentralizzazione è la scalabilità progressiva. Invece di fare un investimento massiccio in un unico laboratorio centralizzato (che poi magari resta sotto-utilizzato se la domanda è inferiore al previsto), i sistemi sanitari possono investire gradualmente: ad esempio attivando dispositivi POC in alcune zone pilota, poi espandendo la rete man mano che si dimostra efficace. Ogni dispositivo aggiunto aumenta la capacità diagnostica totale in modo quasi lineare. Questo approccio modulare è molto apprezzato dai fondi internazionali e investitori in sanità globale, perché consente di misurare l’impatto step by step e ridurre il rischio di risorse sprecate. Dal lato industriale, i fornitori di solito favoriscono questa scalabilità modulare offrendo soluzioni chiavi in mano facilmente replicabili (il famoso plug-and-play diagnostico). Ulteriori moduli software (ad es. nuovi pannelli test) possono essere distribuiti via cloud senza dover sostituire l’hardware, aumentando la scalabilità funzionale oltre che quantitativa.
In sintesi, la decentralizzazione porta un cambio di paradigma: la diagnostica non è più vista come un centro di costo fisso, ma come un’infrastruttura diffusa che cresce con il bisogno e genera valore in termini di resilienza e outcome. Naturalmente, serve governance per coordinare la rete (ad es. definire quali test fare in POC e quali centralizzare, garantire qualità omogenea, raccogliere i dati in modo integrato), ma l’esperienza maturata negli ultimi anni indica chiaramente che i sistemi sanitari orientati al territorio sono più efficaci e sostenibili. La diagnostica molecolare distribuita si configura dunque come un pilastro strategico per la sanità del futuro, da affiancare alla telemedicina e alla digital health, in un modello in cui prevenzione, diagnosi e monitoraggio avvengono anywhere, anytime.
6. Espansione in segmenti ad alto margine: nutraceutica, OEM, nuovi use-case
Oltre al core business della diagnostica clinica, il periodo 2024–2030 vedrà la contaminazione della diagnostica molecolare in settori adiacenti, spesso caratterizzati da margini interessanti e modelli di business innovativi.
Nutraceutica e benessere
L’industria degli integratori alimentari e dei prodotti nutraceutici sta crescendo rapidamente e, con essa, la domanda di test di qualità lungo la filiera. Vi è un “mercato nascosto” per test molecolari che verifichino l’autenticità e la purezza degli ingredienti naturali (botanicals, estratti vegetali, probiotici) usati nei supplementi. Ad esempio, tecniche di DNA barcoding o PCR possono confermare che un estratto di erbe contenga davvero la specie dichiarata e non sia adulterato con sostanze meno costose. Inoltre, sul fronte consumer, si diffondono test omics legati al benessere: test microbiota intestinale, test genetici nutrizionali per diete personalizzate, ecc. Questi test, non strettamente diagnostici in senso clinico, costituiscono un segmento premium rivolto al consumatore finale pagante (B2C) o a cliniche di medicina integrativa. Ulisse Biomed, ad esempio, con la sua piattaforma portatile, può servire laboratori conto-terzi che offrono pannelli microbiota direttamente ai nutrizionisti. Margini e pricing in questo ambito tendono ad essere elevati, data la disponibilità del consumatore a pagare per insight personalizzati sulla propria salute. Essere presenti nel settore nutraceutico permette di diversificare il business e scalare i volumi di test anche fuori dal rigido schema dei rimborsi sanitari pubblici.
OEM integrato e co-sviluppi
Molti grandi attori (farmaceutiche, aziende biotech, veterinarie, agroalimentari) necessitano di soluzioni diagnostiche personalizzate da integrare nei loro prodotti o servizi. Esempi: una pharma che sviluppa un nuovo farmaco oncologico può voler offrire anche un test companion per selezionare i pazienti (classico modello pharma + diagnostics); un produttore di attrezzature veterinarie può volere una versione custom di un test PCR portatile per cliniche veterinarie; o ancora, aziende agroalimentari potrebbero integrare un dispositivo molecolare per monitorare patogeni negli allevamenti o nella produzione alimentare. Tutti questi casi rientrano nel modello OEM (Original Equipment Manufacturer) o partnership B2B. Per una società come Ulisse Biomed, fornire piattaforme white-label o co-sviluppare pannelli specifici su richiesta di partner è strategico: consente di vendere volumi elevati di consumabili dedicati e magari licenze software, senza i costi di marketing end-user. Piccole biotech con tecnologie innovative potrebbero preferire appoggiarsi a un ecosistema esistente come Hyris System™ anziché costruire da zero hardware e cloud, licenziando i propri saggi diagnostici da eseguire sul bCUBE™. Queste partnership OEM generano ricavi ricorrenti e creano solide barriere all’uscita (una volta integrato un test in un flusso industriale o clinico di un partner, difficilmente verrà rimosso a breve). Il segmento OEM diagnostics è atteso in crescita, alimentato anche dal trend di companion diagnostics e dalla necessità di test rapidi in vari settori industriali (ambientale, food safety, ecc.).
Point-of-Care in nuovi contesti clinici
I primi anni della diagnostica POC molecolare si sono concentrati su malattie infettive (respiratorie, HIV, ecc.) e su contesti di emergenza. Ma il futuro vedrà un’estensione verso segmenti clinici ad alto valore aggiunto: oncologia (biopsie liquide portatili per mutazioni chiave, per esempio nei centri oncologici periferici), salute femminile (test molecolari in ginecologia: HPV, infezioni vaginali,), malattie croniche (pannelli di monitoraggio per pazienti diabetici o nefropatici per intercettare precocemente complicanze). Un altro ambito di margine è la medicina del lavoro e dello sport: immaginare test genetici rapidi per valutare predisposizioni o recupero atletico, eseguiti on-site in centri sportivi o aziende (un potenziale mercato corporate). Questi utilizzi vanno oltre il tradizionale “esame di laboratorio” e diventano parte di servizi integrati (piani di prevenzione, programmi wellness aziendali, etc.). Poiché spesso non sono coperti da rimborsi standard, vengono offerti in regime privatistico con pricing premium. Ad esempio, alcune cliniche private offrono pacchetti di check-up avanzati che includono anche test molecolari rapidi (da infezioni sessualmente trasmesse a predisposizioni genetiche metaboliche): il paziente paga per la convenienza di avere risposte immediate e un quadro completo in giornata.
In tutti questi segmenti “non tradizionali”, la decentralizzazione e la velocità sono un valore aggiunto forte, e chi produce tecnologie POC può adattare la propria offerta per penetrarli. Servirà un’attenta strategia di posizionamento per ciascun verticale (ad esempio, nel nutraceutico puntare sulla certificazione di qualità supply-chain; nell’oncologia puntare sulla complementare ai test di laboratorio; nell’OEM garantire flessibilità e supporto allo sviluppo). La capacità di Ulisse Biomed di fungere da “piattaforma abilitante” – con hardware e software modulare su cui costruire applicazioni specifiche – sarà un asset importante per cogliere queste opportunità ad alto margine.
7. Scenari futuri: consolidamento competitivo, M&A e piattaforme integrate
Entro il 2030, ci aspettiamo un panorama della diagnostica molecolare distribuita abbastanza diverso da quello odierno, frutto di consolidamenti e maturazione del settore. Alcune tendenze chiave in arrivo:
- M&A e consolidamento: Negli ultimi anni abbiamo già assistito a acquisizioni strategiche importanti guidate dai colossi del settore.. Ciò significa che potremmo vedere una riduzione del numero di piccoli player indipendenti man mano che questi vengono inglobati dai grandi. Per gli investitori biotech, questo scenario è interessante in ottica di exit: startup con tecnologie innovative ma con reti commerciali limitate potrebbero diventare target di acquisizione, realizzando multipli importanti. Parallelamente, potremmo vedere fusioni tra attori specializzati (ad es. un’azienda forte nei reagenti con una forte nei device portatili) per unire competenze complementari. Un rischio del consolidamento è la possibile diminuzione della competizione e innovazione se troppi attori vengono assorbiti, ma è anche vero che l’ingresso dei big porta capitali e capacità produttiva per scalare a livelli globali le tecnologie POC.
- Partnership strategiche e ecosistemi: Non tutte le collaborazioni prenderanno la forma di M&A. Ci sarà spazio per joint venture e partnership non equity: ad esempio accordi di co-marketing tra produttori di device POC e fornitori di piattaforme cloud/AI per offrire soluzioni integrate; oppure accordi tra aziende diagnostiche e big tech (per integrare diagnostica nei wearable o negli ecosistemi digital health delle Apple, Google, Amazon di turno). Già oggi, realtà come Microsoft e Amazon Web Services offrono piattaforme cloud specifiche per il settore sanitario che potrebbero interoperare con dispositivi POC (fornendo, ad esempio, servizi di AI scalabili on-demand).
- Piattaforme SaaS + cloud (diagnostic cloud ecosystems): Uno scenario molto probabile è che le soluzioni diagnostiche diventino sempre più delle piattaforme digitali, dove l’hardware è solo una componente. I modelli di business tenderanno al SaaS: immaginiamo un laboratorio o un ospedale che sottoscrive un abbonamento per avere X dispositivi installati, connessi a un software cloud che fornisce analisi, aggiornamenti e supporto, pagando magari su base mensile per numero di test effettuati (pay-per-use). Questo modello “diagnostics-as-a-service” sta emergendo e sarà un cambio di paradigma per un’industria storicamente basata sulla vendita di strumenti e reagenti. Dal punto di vista delle aziende, ciò genera ricavi ricorrenti più prevedibili e un rapporto continuativo col cliente. Dal lato cliente, sposta l’onere di mantenimento e aggiornamento sul fornitore, garantendo di avere sempre tecnologia all’avanguardia senza dover reinvestire in capitale. Ulteriori elementi SaaS includeranno app store diagnostici: piattaforme come bAPP™ potrebbero evolvere per ospitare test sviluppati da terzi, scaricabili/attivabili on-demand (simile a come oggi si scarica un’app su smartphone). Insomma, l’hardware diventerà come uno smartphone diagnostico, e il cloud il suo ecosistema di servizi.
- White-spot regionali e nuovi mercati da penetrare: Nonostante la globalizzazione, nel 2030 esisteranno ancora mercati sottoserviti. Pensiamo ad esempio a regioni dell’Africa subsahariana o dell’Asia centrale dove la sanità sta appena ora investendo in base infrastrutturale. Questi saranno i mercati del futuro per la diagnostica distribuita – regioni dove non c’è ancora un player dominante e dove chi arriva per primo può costruire relazioni durature con governi e partner locali. Alcuni paesi con popolazioni enormi (Nigeria, Pakistan, Bangladesh) rappresentano opportunità immense se accompagnano la crescita economica con investimenti sanitari. In parallelo, settori come la veterinaria e la sicurezza alimentare (food safety) potrebbero costituire mercati emergenti per test molecolari decentrati: ad esempio allevatori che usano kit portatili per monitorare infezioni negli animali in tempo reale, oppure ispettori alimentari che testano sul campo contaminanti con PCR ambientale. Questi sono campi ancora poco esplorati ma potenzialmente esplosivi in termini di domanda. Le aziende che riusciranno a adattare o riposizionare le proprie piattaforme per questi white spot ne raccoglieranno i frutti.
- Evoluzione delle performance e nuovi paradigmi: Guardando proprio avanti, potremmo anche immaginare un breakthrough tecnologico che cambi ulteriormente le carte: per esempio l’avvento di sequenziatori portatili ultra-veloci (oggi esistono già nanopore sequencers tascabili, ma in futuro potrebbero diventare davvero mainstream, portando il metagenomico in campo), o di biosensori molecolari integrati in smartphone (chip che eseguono amplificazione e lettura direttamente sul telefono). Se tali tecnologie emergeranno, la definizione stessa di “test molecolare distribuito” si amplierà ancora, includendo strumenti indossabili o network di sensori ambientali. In ogni caso, lo spirito dello scenario rimane: portare la potenza analitica dove serve, quando serve.
8. Posizionamento Ulisse Biomed: la visione end-to-end
In questo affresco di innovazione e cambiamento, Ulisse Biomed si pone come abilitatore e protagonista della diagnostica molecolare distribuita. La sua piattaforma Hyris System™ incarna esattamente i principi chiave discussi sinora:
- End-to-end integration: A differenza di approcci frammentati, Ulisse Biomed controlla e integra tutte le componenti: hardware (bCUBE™ – dispositivo PCR portatile miniaturizzato), software (bAPP™ – applicazione cloud e AI per gestione e analisi dati), chimica (kit proprietari stable e validati) e servizi (supporto tecnico, customizzazione OEM). Questo ecosistema unificato garantisce che ogni ingranaggio sia ottimizzato per funzionare con gli altri, offrendo agli utenti finali un’esperienza senza soluzione di continuità. In pratica, accuratezza di laboratorio ovunque, come da mission aziendale.
- Scalabilità e flessibilità: Hyris System™ è concepito per essere scalato sia verticalmente che orizzontalmente. Si può partire con un singolo bCUBE in un laboratorio remoto e arrivare a gestire una flotta di centinaia di dispositivi in cloud. La piattaforma accetta lo sviluppo di nuovi test (pannelli personalizzati per partner OEM, nuovi settori come microbiota, veterinaria, agrifood) con tempi di sviluppo rapidi grazie a un framework flessibile. Questo significa che Ulisse Biomed può rispondere velocemente a nuove esigenze di mercato (es. improvvisa necessità di un test per un nuovo patogeno) distribuendo un aggiornamento software e kit reagenti in poche settimane.
- Focus sull’utente e ROI: Avendo in mente clinici e utilizzatori finali, l’azienda ha puntato su usabilità estrema (il bCUBE è pensato per essere utilizzato anche da personale non specializzato, seguendo pochi passaggi intuitivi) e su metriche di performance che contano per i clienti: rapidità (risultati in 90 minuti o meno), portabilità (device leggero e robusto, trasportabile in una valigetta), costi operativi contenuti (grazie ai reagenti stabili che abbattono sprechi e spese di trasporto).
- Visione strategica e partnership: Ulisse Biomed non vede il proprio ruolo limitato al “vendere macchinari”, ma piuttosto come partner strategico di chi vuole innovare in diagnostica. Ha già attivato collaborazioni con laboratori privati per l’offerta di test nutrigenetici su piattaforma Hyris, ed è aperta a progetti con aziende farmaceutiche per sviluppare insieme soluzioni companion diagnostiche. Inoltre, l’azienda dialoga con istituzioni accademiche per validare nuovi pannelli (HPV, sepsi, malattie rare) e con enti pubblici per progetti pilota di sorveglianza epidemiologica territoriale basata su reti di bCUBE (un concetto di distributed surveillance dove ogni macchina sul campo diventa un nodo sentinella, contribuendo dati in tempo reale a un osservatorio centrale[6]). Questa capacità di tessere una rete intorno alla propria tecnologia è fondamentale per restare all’avanguardia ed espandere l’impatto.
- Innovazione continua: Coerente con i trend discussi, Ulisse Biomed sta integrando AI e cloud analytics nel suo bAPP. Ad esempio, utilizza algoritmi proprietari per controllare qualità e validità di ogni corsa PCR, e in roadmap ci sono funzioni di predizione (es. correlare cariche virali con probabilità di outcome) e di machine learning federato per migliorare continuamente l’accuratezza dei test con i dati raccolti sul campo. L’azienda monitora da vicino anche le evoluzioni hardware: ad esempio, è in sviluppo uno strumento automatizzato per la preparazione dei campioni per la fase analitica. Questa mentalità di open innovation assicura che Hyris System™ rimanga non un prodotto statico, ma una piattaforma evolutiva in linea con lo stato dell’arte e i bisogni emergenti dei clienti.
In conclusione, Ulisse Biomed si presenta come un case study virtuoso di come un’azienda può posizionarsi nel mercato 2024–2030: visione strategica solida (decentralizzazione come chiave di sostenibilità), padronanza tecnica (ecosistema modulare integrato) e orientamento al cliente (soluzioni ritagliate sui bisogni di clinici, partner e investitori). Questa combinazione la rende capace di scalare nei mercati distribuiti e segmenti emergenti con successo. Mentre il settore si dirige verso scenari di consolidamento e modelli SaaS, Ulisse Biomed – forte della sua identità di provider end-to-end – ha gli strumenti per essere non solo adattabile al cambiamento, ma motore stesso del cambiamento verso una diagnostica più vicina al paziente, più intelligente e più sostenibile.
Conclusioni
Il decennio 2024–2030 si prospetta come un periodo di evoluzione accelerata per la diagnostica molecolare distribuita. Dalla crescita robusta del mercato globale all’espansione in nuove geografie e settori, fino alla convergenza con il digitale e l’AI, abbiamo delineato scenari ricchi di opportunità. Per gli investitori biotech, i direttori di laboratorio, i partner OEM e i decisori sanitari, il messaggio è chiaro: la decentralizzazione dei test non è più una nicchia sperimentale, ma un fenomeno centrale destinato a ridefinire paradigmi di cura e modelli di business.
In questo contesto di trasformazione, Ulisse Biomed si propone non solo come fornitore di tecnologia, ma come partner strategico in grado di accompagnare organizzazioni e sistemi sanitari verso il futuro della diagnostica.
Il viaggio verso una diagnostica molecolare più capillare, resiliente e intelligente è iniziato. I prossimi anni vedranno consolidarsi i frutti degli investimenti odierni e nascere imprese e modelli oggi impensabili. Chi saprà anticipare i trend – puntando su innovazione, interoperabilità, qualità e valore – guiderà la nuova era. Ulisse Biomed, con il suo ecosistema Hyris System™, ambisce a essere uno di questi leader pionieri, portando l’eccellenza diagnostica ovunque ce ne sia bisogno e generando valore tangibile per pazienti, operatori e stakeholder finanziari. Il laboratorio del futuro è diffuso, connesso e data-driven: le fondamenta sono gettate, il mercato è pronto a crescere.
Fonti e Bibliografia
Sources and Bibliography
- [1] [2] [3] Point of Care Diagnostics Market Size, Share & Trends Analysis Report by Product (Infectious Diseases, Glucose Testing, Cardiac Markers), End Use (Clinics, Home, Hospitals), Region, with Growth Forecasts, 2025–2030
- [4] FDA — CLIA Waiver by Application
- [5] FDA — CLIA Categorizations
- [6] Ulisse Biomed — Decentralised Diagnostics: Growth and Future of the Market