20 agosto 2025
Tempo di lettura [minuti]: 12
Tendenze di Mercato e del Settore
Medicina personalizzata: potenzialità e investimenti per la sanità del futuro
Diagnostica molecolare multiplex decentralizzata per percorsi terapeutici più rapidi, scalabili e sostenibili.
Abstract
La medicina personalizzata si sta affermando come paradigma chiave per la sanità del futuro, spostando l’approccio da terapie “one-size-fits-all” a cure su misura basate sul profilo genetico e molecolare del paziente. Questo articolo esamina da una prospettiva strategica e industriale le implicazioni cliniche, economiche e tecnologiche di questa rivoluzione. Analizziamo come i progressi in diagnostica molecolare multiplex – piattaforme decentralizzate, modulari e integrabili – abilitino modelli di cura scalabili e sostenibili, riducendo i tempi di risposta e ottimizzando i percorsi terapeutici. Con riferimenti accademici e case study, offriremo insight per investitori biotech, board clinici, OEM e stakeholder istituzionali, evidenziando il ruolo di Ulisse Biomed come abilitatore infrastrutturale di una nuova generazione di medicina personalizzata.
Snapshot
-
Medicina personalizzata (o di precisione)Approccio medico che adatta prevenzione, diagnosi e terapia alle caratteristiche individuali del paziente (profilo genetico, biomarcatori, stile di vita), superando il modello standard uguale per tutti. Obiettivo: massimizzare l’efficacia del trattamento e ridurre effetti inutili o indesiderati.
-
qPCR multiplexTecnica di PCR quantitativa in real-time capace di rilevare più bersagli genetici contemporaneamente in un unico test. Permette di diagnosticare panel di patogeni o biomarcatori in parallelo (es. più virus respiratori in un solo tampone), aumentando efficienza e rapidità rispetto a test singoli.
-
TAT (Turn-Around Time)Tempo di completamento di un test diagnostico, dall’esecuzione al referto. Nella diagnostica tradizionale può essere di giorni; soluzioni point-of-care e multiplex mirano a ridurre drasticamente il TAT (anche a <1 ora) migliorando la tempestività clinica.
-
Companion diagnostics (diagnostici companion)Test diagnostici associati a uno specifico farmaco mirato, eseguiti prima o durante la terapia per determinare la presenza di un biomarcatore predittivo di risposta. Esempio: test genetici come EGFR o ALK in oncologia che indicano se un paziente beneficerà di un certo farmaco target. Essenziali per terapie personalizzate sicure ed efficaci.
- Introduzione
- 1. Impatto clinico: verso terapie su misura e migliori outcome
- 2. Innovazione tecnologica: diagnostica avanzata, decentralizzata e integrata
- 3. Impatto economico e modelli di business sostenibili
- 4. Modelli di ricavo innovativi in diagnostica personalizzata
- 5. Intervista a Bruna Munari, Fondatrice e Board Member di Ulisse Biomed
- Conclusione proiettiva
Introduzione
La medicina personalizzata promette di trasformare la cura rendendola più efficace, predittiva e centrata sul paziente. Molti trattamenti standard risultano efficaci solo in una minoranza di individui: evidenze consolidate mostrano che il modello “one‑size‑fits‑all” genera inefficienze cliniche ed economiche (es. esposizioni a terapie poco utili, iter diagnostici ripetuti, ritardi decisionali) che la stratificazione molecolare può prevenire fin dall’inizio del percorso terapeutico [1]. Questo approccio generico comporta sprechi di risorse e costi aggiuntivi dovuti a effetti avversi, iter diagnostici ripetuti e ritardi nel trovare la terapia giusta [2]. La medicina personalizzata nasce per superare questi limiti, combinando i progressi della genomica, della data analytics e della diagnostica avanzata: invece di procedere per tentativi, si stratificano i pazienti in sottogruppi molecolari, mirando fin dall’inizio il trattamento più adatto a ciascuno. In questo modo aumenta la probabilità di risposta positiva e si riducono esposizioni inutili a farmaci poco efficaci [3].
Negli ultimi anni, diverse convergenze tecnologiche hanno accelerato questa visione. Il costo del sequenziamento genomico è crollato (da miliardi di dollari a poche centinaia), mentre nuove tecnologie come CRISPR e liquid biopsy hanno aperto scenari impensabili per diagnosticare e monitorare le malattie a livello molecolare. Parallelamente, organi regolatori e sistemi sanitari hanno iniziato a riconoscere il valore della medicina personalizzata: nel 2018 circa il 40% dei nuovi farmaci approvati dalla FDA erano terapie di precisione (spesso accompagnate da un test diagnostico) [4]. Consorzi internazionali e programmi governativi (come l’ICPerMed europeo e la PMI americana) sostengono finanziariamente ricerca e implementazione, evidenziando l’impegno globale verso un’assistenza più efficiente ed equa [5][6]. Tuttavia, restano sfide aperte: integrare la medicina personalizzata nei flussi clinici esistenti, renderla sostenibile in termini di costi e infrastrutture, e soprattutto scalare queste innovazioni fuori dai centri d’eccellenza, verso una diffusione capillare.
In questo contesto, la diagnostica molecolare riveste un ruolo cruciale come abilitatore: identificare rapidamente biomarcatori e mutazioni è la premessa per trattamenti mirati tempestivi. Strumenti come la PCR multiplex in tempo reale, i pannelli NGS mirati e i test point‑of‑care ad alta sensibilità costituiscono la “spina dorsale” tecnica della medicina personalizzata sul campo. Ulisse Biomed, con la piattaforma Hyris System™ e un ecosistema integrato di dispositivi portatili, reagenti proprietari e cloud, si posiziona proprio in questo spazio – come partner tecnologico capace di decentralizzare e rendere modulare la diagnostica molecolare avanzata. Nel prosieguo, analizzeremo le potenzialità cliniche, tecnologiche ed economiche di questo nuovo paradigma, quindi proporremo un confronto con Bruna Marini (founder e Board Member di Ulisse Biomed) sul ruolo industriale e strategico dell’azienda.
1. Impatto clinico: verso terapie su misura e migliori outcome
Un altro esempio emblematico è la riduzione delle chemioterapie non necessarie. Studi su larga scala hanno mostrato che, testando geneticamente i tumori al seno prima di decidere la terapia, una quota rilevante di pazienti può evitare la chemio: ad esempio MINDACT indica che ≈46% delle donne clinicamente ad alto rischio ma a basso rischio genomico può rinunciare alla chemioterapia con outcome sovrapponibili; TAILORx mostra che per la maggior parte delle pazienti con punteggi intermedi del test a 21 geni la chemio non aggiunge beneficio rispetto alla sola terapia endocrina [9][10]. Analogamente, nell’ambito dei tumori del colon metastatico, l’uso routinario di test genetici (es. mutazione KRAS) per guidare la scelta terapeutica genera risparmi sanitari sostanziali, con stime nell’ordine delle centinaia di milioni di dollari l’anno negli USA, evitando anti‑EGFR inefficaci nei pazienti non responder [11][12]. Questi dati sottolineano un doppio vantaggio: clinico (terapie più appropriate, pazienti che vivono più a lungo e con migliore qualità di vita) ed economico (risorse reinvestibili altrove anziché sprecate in trattamenti infruttuosi).
Dal punto di vista operativo, la medicina personalizzata rende necessario integrare sempre più la diagnostica nel percorso di cura. Concetti come companion diagnostics e theranostics (terapie con diagnostico incorporato) diventano parte integrante dei protocolli: ad esempio, nei tumori polmonari l’algoritmo diagnostico‑terapeutico prevede oggi test molecolari immediati sul campione bioptico per decidere se il paziente riceverà una terapia a bersaglio molecolare o immunoterapia. Anche fuori dall’oncologia, si affermano test personalizzati: pannelli farmacogenetici che guidano la scelta dei farmaci in psichiatria (evitando antidepressivi inefficaci in base al metabolismo del paziente) o score genetici che predicono il rischio cardiovascolare e orientano misure preventive su individui ad alto rischio. In sintesi, il modello clinico sta evolvendo: da un lato i pazienti ricevono cure più mirate e potenzialmente più efficaci; dall’altro i clinici dispongono di nuovi strumenti decisionali basati su dati molecolari oggettivi. Studi internazionali confermano che questi approcci portano complessivamente a esiti migliori e a un uso più efficiente delle risorse sanitarie [3].
2. Innovazione tecnologica: diagnostica avanzata, decentralizzata e integrata
La decentralizzazione della diagnostica resa possibile da queste tecnologie ha un impatto diretto sui modelli clinici: test molecolari eseguiti sul posto (Point‑of‑Care Testing) eliminano i ritardi legati al trasporto dei campioni e all’attesa dei risultati centralizzati [12]. Ciò significa poter iniziare un trattamento mirato durante la stessa visita o nel giro di poche ore anziché giorni. Ad esempio, nei pazienti con sospetta infezione respiratoria, l’uso di pannelli multiplex rapidi per virus e batteri ha dimostrato di aumentare le diagnosi in tempo reale in pronto soccorso e permettere di somministrare antivirali (come l’oseltamivir per influenza) prima della dimissione, rispettando la finestra temporale ottimale di efficacia [12]. Studi dell’American Society for Microbiology evidenziano come i pannelli molecolari multiplex abbiano una sensibilità superiore ai metodi tradizionali e forniscano risposte in tempi utili per le decisioni cliniche, con possibilità di sostituire batterie di esami convenzionali e migliorare efficienza e costi [12].
Un aspetto chiave dell’innovazione è la modularità: le piattaforme moderne permettono di scalare progressivamente la capacità diagnostica aggiungendo moduli o dispositivi in parallelo [13]. Questo approccio modulare e scalabile è al centro della strategia Ulisse Biomed: grazie alla verticalizzazione hardware‑software‑reagenti, ogni componente comunica nativamente con gli altri e nuovi moduli (sia strumenti che servizi cloud) possono essere integrati senza discontinuità [13]. Ad esempio, un partner OEM può decidere di utilizzare l’ecosistema Hyris aggiungendo propri test customizzati, oppure un ospedale può connettere sistemi esterni tramite il gateway bGATE™ integrando tutti i dati su un’unica piattaforma cloud [13]. L’interoperabilità con LIS ospedalieri e database esterni è infatti un requisito imprescindibile per la medicina personalizzata data‑driven [5]; soluzioni cloud come bAPP™ permettono di centralizzare risultati provenienti da fonti diverse e applicare algoritmi di interpretazione (ML/AI) su scala [13].
Infine, l’integrazione verticale di tecnologie innovative consente di superare barriere logistiche che in passato ostacolavano la diffusione sul campo. Un esempio è la formulazione di reagenti ambient‑stabili che non richiedono la catena del freddo: Ulisse Biomed ha sviluppato kit liofilizzati utilizzabili a temperatura ambiente, eliminando la necessità di frigoriferi per trasporto e stoccaggio [13]. Ciò abilita l’impiego di test molecolari in contesti remoti o a basse risorse, ampliando l’accesso alla medicina di precisione. Analogamente, l’automazione “sample‑to‑answer” (nei sistemi che la prevedono) e workflow semplificati riducono gli step manuali, consentendo anche a personale non specializzato di eseguire test genetici con facilità [12]. In sintesi, l’innovazione tecnologica sta rendendo la medicina personalizzata praticabile su larga scala, abbattendo i tempi (risultati in tempo reale su cloud), i costi per test (grazie a consolidamento e multiplexing) e le barriere geografiche (diagnostica portatile decentralizzata).
3. Impatto economico e modelli di business sostenibili
Dal punto di vista dell’industria biotech e farmaceutica, la medicina personalizzata sta modificando le strategie di investimento. Le grandi aziende hanno progressivamente spostato il focus verso farmaci target: analisi storiche indicano che ~42% dei composti in pipeline sono personalized/biomarker‑driven, mentre in oncologia cresce il peso di modalità terapeutiche “novel” (cell & gene, ADC, multispecific) che riflettono l’evoluzione verso approcci mirati [18][15]. Anche gli investitori istituzionali seguono il trend: nel 2022 il fundraising VC in healthcare ha sfiorato i 22 mld $ (secondo miglior anno della serie), e deal di grandi dimensioni nel perimetro “precision‑driven” (es. ElevateBio 401 M$ per terapie genetiche) mostrano l’interesse del capitale paziente verso piattaforme scalabili [16][17]. Questa fiducia è motivata dalle opportunità di ritorno nel medio termine: benché i costi iniziali per infrastrutture e validazioni siano elevati, il ROI potenziale include nuovi mercati (gene/cell therapy, diagnostica data‑driven), ricavi ricorrenti e allineamento con policy di rimborso orientate agli outcome [14][19].
Le previsioni di mercato riflettono questo scenario in espansione, con stime molto diverse a seconda delle definizioni: a livello “segmento”, IQVIA prevede la spesa globale in farmaci oncologici a ~409 mld $ entro il 2028 (driver primario della precision medicine), mentre BCC Research stima il mercato globale della precision medicine a ~100,5 mld $ nel 2028 (CAGR ~13,2%) e i companion diagnostics a ~15,4 mld $ (CAGR ~15,2%) [15][20][21]. In parallelo, stanno emergendo modelli di business nell’area diagnostica e dei servizi personalizzati: Dx‑as‑a‑Service per strutture che preferiscono pagare per test anziché investire in capex, co‑sviluppo farmaco‑diagnostico e accordi OEM in cui piattaforme come Hyris System™ vengono integrate in soluzioni di terzi, con ricavi da licensing, reagenti e servizi cloud [13][19].
In definitiva, la medicina personalizzata può conciliare innovazione e sostenibilità solo adottando approcci industriali nuovi. Serve un ecosistema in cui stakeholder pubblici e privati collaborino: rimborsi mirati e programmi di investimento da un lato; dall’altro, Real‑World Evidence per dimostrare impatto economico (riduzione di sprechi, complicanze e ricoveri). In questo quadro, realtà come Ulisse Biomed possono fungere da partner infrastrutturali: piattaforme diagnostiche flessibili su cui ospedali, pharma e centri di ricerca costruiscono verticali personalizzati [14][13][19].
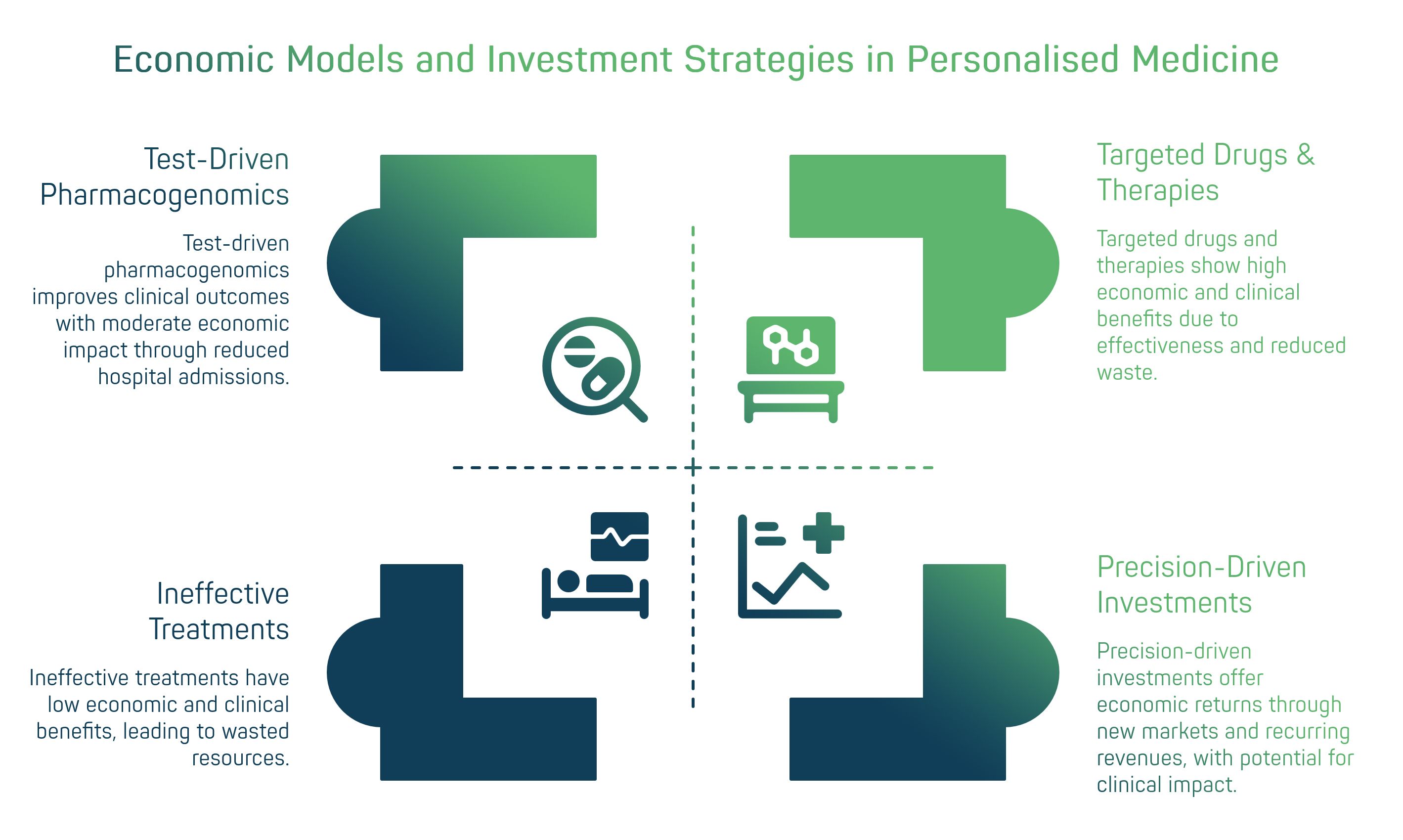
4. Modelli di ricavo innovativi in diagnostica personalizzata
OEM (Original Equipment Manufacturer): Collaborazione in cui un’azienda diagnostica fornisce la propria piattaforma tecnologica affinché un partner la integri nel proprio prodotto o servizio. Nel caso di Ulisse Biomed, la piattaforma Hyris System™ può essere fornita in OEM a sviluppatori di kit diagnostici terzi, che la utilizzano come backbone tecnico per i loro test personalizzati. Questo modello genera ricavi tramite accordi di licensing, forniture di hardware/reagenti e supporto tecnico, ampliando la diffusione della tecnologia Ulisse Biomed nei mercati raggiunti dai partner.
DaaS (Diagnostics-as-a-Service): Modello “a servizio” in cui il cliente (es. un ospedale o una farmacia) non acquista direttamente strumenti o kit, ma paga in base all’utilizzo (per test o in abbonamento periodico). Ulisse Biomed può offrire il proprio ecosistema diagnostico in formula service, installando dispositivi bCUBE e fornendo reagenti, cloud e assistenza, mentre il cliente paga un fee per ogni analisi effettuata. Questo garantisce un flusso di revenue ricorrente all’azienda e abbassa la barriera di ingresso per l’utente finale, che evita l’investimento iniziale capital-intensive.
Co-sviluppo (co-development): Partnership strategica tra un’azienda diagnostica e un’altra entità (ad es. una biotech farmaceutica, un istituto di ricerca o un ente sanitario) per sviluppare congiuntamente nuovi test o pannelli personalizzati. In tali accordi si condividono costi di R&D e competenze: Ulisse Biomed può apportare la piattaforma tecnologica e il know-how in validazione diagnostica, mentre il partner porta campioni, accesso a pazienti o molecole innovative. I modelli di ricavo prevedono la condivisione degli utili derivanti dal successo commerciale del nuovo test, oltre a possibili milestone payments durante lo sviluppo. Il co-sviluppo accelera l’innovazione (unendo forze complementari) e crea legami di lungo termine con stakeholder chiave (ad es. sviluppando un companion diagnostic assieme a chi produce il farmaco correlato).

Bruna Munari
Fondatrice e Board Member di Ulisse Biomed
Intervista
D: Bruna, come descriverebbe la visione di Ulisse Biomed riguardo alla medicina personalizzata e il suo impatto sul settore diagnostico? Qual è il ruolo che l’azienda ambisce a giocare in questo panorama in evoluzione?
R: La nostra visione è che la medicina personalizzata non sia solo un trend scientifico, ma un cambio di paradigma che richiede nuove “infrastrutture” diagnostiche. Ulisse Biomed nasce proprio con l’obiettivo di fornire queste infrastrutture. In pratica, vogliamo democratizzare l’accesso alla diagnostica molecolare avanzata, portandola fuori dai laboratori centralizzati e integrandola nei percorsi di cura quotidiani. Per fare ciò, abbiamo unito competenze biotech e digital per creare un ecosistema completo – l’Hyris System™ – dove hardware, software e reagenti sono progettati insieme. Nel contesto della medicina personalizzata, questo significa che un ospedale, un’azienda farmaceutica o un partner può utilizzare la nostra piattaforma per eseguire test genetici e molecolari dove e quando serve, ottenendo risultati affidabili in tempo reale e condividendoli sul cloud. In sostanza, ci posizioniamo come abilitatore tecnologico: forniamo la “spina dorsale” su cui altri possono costruire soluzioni personalizzate, dai test companion per terapie oncologiche, ai pannelli su misura per il microbiota di un paziente. Crediamo che questo approccio integrato e distribuito possa avere un impatto enorme: ridurre i tempi diagnostici, migliorare gli outcome clinici e rendere sostenibile l’adozione della medicina di precisione su larga scala.
D: In che modo la diagnostica molecolare multiplex, decentralizzata e modulare – come quella dell’Hyris System™ – abilita modelli clinici più rapidi e scalabili? Ci può fare qualche esempio concreto di benefici in ambito clinico?
R: Certo. Pensiamo ad esempio alla gestione delle malattie infettive emergenti o alla diagnostica in pronto soccorso. Tradizionalmente, per identificare un patogeno raro o multipli agenti infettivi si doveva inviare il campione a un laboratorio di riferimento, attendere magari 2-3 giorni il risultato e nel frattempo trattare il paziente empiricamente. Con una soluzione decentralizzata e multiplex come la nostra, invece, il test viene eseguito direttamente sul campo o nel reparto, e può cercare simultaneamente – in un’unica reazione – tutti i principali patogeni rilevanti. Il risultato, disponibile ad esempio in 90 minuti, permette al medico di prendere subito decisioni informate (isolamento del paziente, scelta mirata dell’antibiotico o antivirale). Questo ha portato in alcuni ospedali pilota a una riduzione drastica del Turn-Around-Time e a un miglioramento delle cure: pazienti trattati prima e in modo corretto, minori complicanze e anche minori costi ospedalieri perché si evita di tenere ricoverato un paziente in attesa delle analisi. Un altro esempio concreto è quello della medicina territoriale o dei paesi a risorse limitate: grazie ai nostri bCUBE portatili alimentabili a batteria, organizzazioni sanitarie hanno potuto effettuare screening genetici e test di resistenza a farmaci direttamente in villaggi remoti o sul campo (penso a un progetto in Africa per monitorare la malaria). Decentralizzare la diagnostica significa portare la medicina personalizzata ovunque, non solo nei grandi centri: questo è cruciale per renderla davvero inclusiva. Dal punto di vista tecnico, il fatto di avere un sistema modulare aiuta la scalabilità: un partner può partire con pochi dispositivi e pochi test e poi crescere aggiungendo man mano altri moduli – il tutto senza cambiare piattaforma. Questa flessibilità facilita l’adozione, perché ognuno può “cucirsi addosso” la configurazione diagnostica più adatta e ampliarla nel tempo.
D: Guardiamo al modello di business e agli investimenti. La medicina personalizzata comporta costi importanti in R&D e nuove modalità di collaborazione. Quali modelli di ricavo Ulisse Biomed sta perseguendo per coniugare innovazione tecnologica e sostenibilità economica?
R: È una domanda centrale. Noi abbiamo fin dall’inizio scelto di diversificare i modelli di ricavo, proprio per avere flessibilità nel mercato emergente della medicina personalizzata. In primo luogo, adottiamo un modello misto prodotti + servizi: forniamo dispositivi e kit diagnostici, ma li integriamo con software e piattaforme cloud che generano ricavi ricorrenti (modalità SaaS o fee per test). Ad esempio, il nostro bAPP cloud offre analisi avanzate e aggiornamenti continui di intelligenza artificiale. In parallelo, puntiamo molto su partnership OEM e co-sviluppi. Questo significa che non vendiamo solo al cliente finale, ma anche ad altri attori industriali: per esempio, stringiamo accordi con aziende farmaceutiche per sviluppare insieme un companion diagnostic legato a un loro farmaco – condividendo sia i costi sia poi i benefici delle vendite. Abbiamo accordi OEM in cui i nostri bCUBE vengono brandizzati o integrati in soluzioni di partner diagnostici più grandi, portandoci revenue e amplificando la diffusione della nostra tecnologia a mercati che da soli non raggiungeremmo. Questi modelli collaborativi sono win-win: Ulisse Biomed monetizza la propria piattaforma tecnologica senza dover essere direttamente presente in ogni nicchia, e il partner arricchisce la propria offerta con uno strato innovativo. Dal punto di vista degli investimenti, questo approccio diversificato è stato apprezzato anche dai nostri finanziatori e shareholders: riduce il rischio perché non dipendiamo da un’unica fonte di reddito o da un singolo successo di prodotto. Infine, stiamo esplorando formule Diagnostics-as-a-Service, dove installiamo le nostre piattaforme presso grandi clienti e loro pagano per utilizzo, come servizio operativo. Questo modello è particolarmente interessante per cliniche e laboratori che vogliono aggiornarsi alla diagnostica di precisione senza però dover investire grandi capitali upfront: noi forniamo l’infrastruttura, loro la usano pagando in base al volume. In sintesi, flessibilità e partnership sono le parole chiave: in un settore nuovo come questo, crediamo che adattarsi alle esigenze dei vari stakeholder sia fondamentale per affermarsi e generare valore di lungo periodo.
D: Infine, quali sfide e opportunità intravede nei prossimi 5-10 anni per Ulisse Biomed e, più in generale, per l’ecosistema della medicina personalizzata?
R: La prossima decade sarà cruciale. Sul fronte delle opportunità, vediamo un’enorme espansione dei campi applicativi: la medicina personalizzata andrà oltre l’oncologia per permeare immunologia, malattie rare, medicina preventiva. Ci sarà bisogno di soluzioni diagnostiche sempre più integrate con i dati clinici: penso a piattaforme che combinino sequenziamento, wearable e intelligenza artificiale per fornire al medico una visione a 360° del paziente. Per Ulisse Biomed questo significa continuare a innovare sia in laboratorio (nuovi pannelli Sagitta per biomarcatori emergenti, algoritmi AI più potenti per l’analisi di big data diagnostici) sia sul campo, dove vogliamo consolidare la nostra presenza internazionale. Un punto di forza sarà sicuramente l’interoperabilità: chi riuscirà a collegare i propri sistemi con gli ecosistemi digitali degli ospedali e con le banche dati pubbliche avrà un vantaggio, perché la medicina personalizzata è per definizione data-driven*. Noi ci stiamo muovendo per certificare la nostra piattaforma in più Paesi, integrarla con i principali LIS e magari sfruttare standard globali come HL7/FHIR per lo scambio di dati genomici. Quanto alle sfide, ne vedo alcune importanti. Prima di tutto, la regolamentazione: man mano che i test diventano più complessi (es. algoritmi multigenici, intelligenza artificiale che interpreta dati diagnostici), gli enti regolatori dovranno adattare le normative per garantire efficacia e sicurezza senza però soffocare l’innovazione. Servirà dialogo continuo tra industria e regolatori, e aziende come la nostra dovranno investire in qualità e compliance sin dalle fasi di R&D. Un’altra sfida è la gestione dei dati e la privacy: la medicina personalizzata genera dati sensibili (genomi, predisposizioni) e occorre trattarli con la massima tutela, guadagnando la fiducia dei pazienti. Stiamo sviluppando architetture cloud con alti standard di sicurezza e anonimizzazione perché sappiamo che questo aspetto sarà determinante anche per l’accettazione sociale. Infine, una sfida “culturale”: portare la medicina personalizzata nella pratica clinica quotidiana richiede formazione dei medici e dei laboratoristi. Non basta fornire la tecnologia; dobbiamo spiegare e dimostrare il valore aggiunto.
In conclusione, sono molto fiduciosa: credo che Ulisse Biomed abbia il vantaggio di essere nata già con questa mission e questo DNA innovativo. Siamo agili e focalizzati. Se continueremo a mettere il paziente e gli outcome al centro, lavorando a fianco di clinici e ricercatori, sono convinta che potremo non solo cogliere le opportunità, ma contribuire attivamente a plasmare un ecosistema di medicina personalizzata realmente efficace e sostenibile.
Conclusione proiettiva
La medicina personalizzata rappresenta una svolta epocale per i sistemi sanitari e l’industria delle scienze della vita. Da una prospettiva strategica, le sue potenzialità cliniche (migliori outcome, terapie su misura, prevenzione proattiva) vanno di pari passo con opportunità tecnologiche ed economiche senza precedenti. Come abbiamo visto, strumenti diagnostici innovativi – dai pannelli multiplex portatili all’analisi cloud dei big data genomici – stanno trasformando il modo in cui raccogliamo e utilizziamo le informazioni sul paziente, avvicinando la diagnosi al punto di cura e riducendo i tradizionali colli di bottiglia. Allo stesso tempo, investitori e stakeholder istituzionali riconoscono sempre più il valore di questi modelli: ingenti capitali affluiscono nel settore e politiche sanitarie emergenti puntano a sostenere approcci che offrano maggiore efficienza e qualità rispetto allo status quo.
Permangono certamente sfide, dalla sostenibilità finanziaria di terapie dal costo elevato alla necessità di evidenze solide del beneficio in real-world. Ma l’orizzonte a medio termine appare favorevole: la visione per il 2030 delineata dai consorzi internazionali è quella di un sistema sanitario in cui la medicina personalizzata sia pienamente integrata, con un impatto tangibile in termini di salute pubblica e sviluppo economico[5][6]. Si prospetta un futuro in cui ogni paziente potrà accedere a test molecolari rapidi e mirati, con risultati immediatamente utilizzabili per scegliere la terapia ottimale; un futuro in cui i dati di milioni di persone, opportunamente aggregati e analizzati, guideranno nuove scoperte e politiche di prevenzione più efficaci; un futuro in cui modelli di business collaborativi faranno convergere industria, sistema pubblico e ricerca verso l’obiettivo comune di cure più efficaci, sicure e sostenibili per la popolazione.
Ulisse Biomed intende essere protagonista di questo futuro. Come evidenziato, l’azienda si posiziona come abilitatore infrastrutturale, fornendo tecnologie e soluzioni che permettono di attuare concretamente la medicina personalizzata su scala industriale. Dalla piattaforma Hyris System™ – che decentralizza la diagnostica mantenendo standard elevati – alla capacità di creare partnership in co-sviluppo, Ulisse Biomed costruisce ponti tra innovazione e applicazione pratica. La strada è tracciata: investire in medicina personalizzata significa investire in una sanità più intelligente e data-driven, che sappia coniugare la rigorosità scientifica con la visione strategica. Le potenzialità cliniche e tecnologiche ci sono tutte, gli investimenti stanno arrivando: la sfida dei prossimi anni sarà trasformare queste promesse in realtà quotidiana, rendendo la medicina personalizzata non un privilegio per pochi ma uno standard per tutti. Ulisse Biomed, con le sue solide basi cliniche, tecniche e finanziarie, ambisce a guidare questo cambiamento come partner di riferimento per istituzioni e imprese nel costruire insieme la sanità di nuova generazione.
Fonti e Bibliografia
- Cleary, M. A Review of Precision Medicine, Companion Diagnostics, and the Challenges Surrounding Targeted Therapy. Value & Outcomes Spotlight (ISPOR). July/August 2019. PDF
- Ocaña, A. et al. Influence of companion diagnostics on efficacy and safety of targeted anti-cancer drugs: systematic review and meta-analyses. Oncotarget. 2015;6(37):39538–39549. PMCID: PMC4741844 · DOI
- Vicente, A.M. et al. How personalised medicine will transform healthcare by 2030: the ICPerMed vision. Journal of Translational Medicine. 2020;18:180. Full text · DOI
- Personalized Medicine Coalition (PMC). Personalized Medicine at FDA: A Progress & Outlook Report (2018). 2019. PDF
- ICPerMed. The ICPerMed Vision for 2030: How can personalised approaches pave the way to next-generation medicine? 2019. PDF
- White House (archived). FACT SHEET: President Obama’s Precision Medicine Initiative. Jan 30, 2015. Link
- Schwaederle, M. et al. Association of biomarker‑based treatment strategies with response rates and progression‑free survival in refractory malignant neoplasms: a meta‑analysis. JAMA Oncology. 2016;2(11):1452–1459. Article · DOI
- Cardoso, F. et al. 70‑Gene Signature as an Aid to Treatment Decisions in Early‑Stage Breast Cancer (MINDACT). New England Journal of Medicine. 2016;375:717–729. Article · DOI
- Sparano, J.A. et al. Adjuvant Chemotherapy Guided by a 21‑Gene Expression Assay in Breast Cancer (TAILORx). New England Journal of Medicine. 2018;379:111–121. Article · DOI
- Behl, A.S. et al. Cost‑Effectiveness Analysis of Screening for KRAS and BRAF Mutations in Metastatic Colorectal Cancer. Journal of the National Cancer Institute. 2012;104(23):1785–1795. PMCID: PMC3514165 · DOI
- Kircher, S.M.; Mohindra, N.; Nimeiri, H. Cost Estimates and Economic Implications of Expanded RAS Testing in Metastatic Colorectal Cancer. The Oncologist. 2015;20(1):14–18. PMCID: PMC4294607 · DOI
- American Society for Microbiology (ASM). Clinical Utility of Multiplex Tests for Respiratory and GI Pathogens. Guideline, Aug 23, 2019. Webpage
- Ulisse Biomed. The Hyris System™ modular diagnostic platform (ecosystem overview, bCUBE™, bAPP™, bGATE™, reagenti liofilizzati). ID15 (EN) · bAPP · bGATE · (IT, reagenti liofilizzati)
- Chen, W. et al. Evaluating the Value for Money of Precision Medicine from Early Cycle to Market Access: A Comprehensive Review of Approaches and Challenges. Value in Health. 2023;26(9):1425–1434. Full text · DOI
- IQVIA Institute. Global Oncology Trends 2024: Outlook to 2028. Report
- Silicon Valley Bank (SVB). Healthcare Investments & Exits — Annual Report 2022. Report page · Slides (NVCA/SVB)
- Axios. ElevateBio raises $401 million in year’s largest biotech VC deal. 2023. Article · Press release
- Personalized Medicine Coalition (PMC). The Personalized Medicine Report — Opportunity, Challenges, and the Future (dataset update through 2020; includes pipeline analysis). PDF · Alt. PDF (pipeline 42%)
- Koleva‑Kolarova, R. et al. Financing and Reimbursement Models for Personalised Medicine: A Systematic Review to Identify Current Models and Future Options. Applied Health Economics and Health Policy. 2022;20(4):501–524. PMCID: PMC9206925 · DOI
- BCC Research. Precision Medicine: Global Markets (2019–2028). Report page
- BCC Research. Companion Diagnostics: Technologies & Global Markets (2023–2028). Report page · Press note